Блоги
Проблемы токсикологии наночастиц металлов
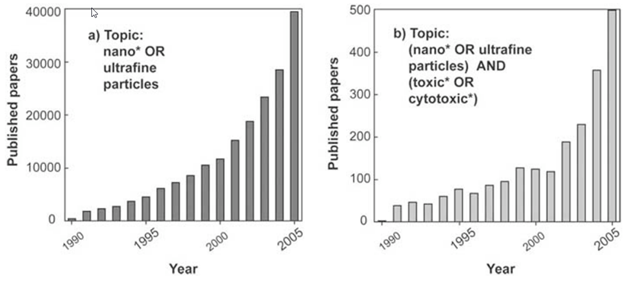
В 1-ой части публикации про медицину и наночастицы металлов были показаны потенциальные возможности и реальное использование нанотехнологий и наночастиц металлов в различных областях медицины. При этом вопросы токсичности наноматериалов и наночастиц были затронуты только в общем виде, что недостаточно особенно для медицины. Открытие нового метода синтеза наночастиц металлов, а именно экологически безопасного экономичного биосинтеза позволило расширить использование наночастиц металлов, особенно серебра и золота, в различных областях науки и техники и, прежде всего, в разных областях медицины. Сначала стали использовать наночастицы металлов в качестве биоцида (антимикробность, антивирусность, противогрибковость) не только в медицине в качестве антисептика. Опираясь на то, что это свойственно солям металлов, в которых сильными биоцидными свойствами обладают катионы Ag+, Au+, Cu+ и др. Затем использование наночастиц металлов в медицине расширилось. Оказалось, что наночастицы металлов имеют не только биоцидные свойства, необходимые в различных материалах медицинского назначения, но они обладают ранозаживляющими, антираковыми, антималярийными и другими лечебными свойствами. Поэтому встал вопрос о безопасности, токсичности наночастиц металлов на всех стадиях производства, хранения, транспортировки, использования и утилизации. В настоящее время на мировом рынке присутствует более двух тысяч нано продуктов. Европейской союз, правительство США и ряд международных организаций реализуют программы, переводящие производство и применение наночастиц металлов на рельсы зеленой химии. Так биосинтез наночастиц металлов решает вопрос замены органических растворителей на воду, использование безопасных биовосстановителей (биополимеры) и стабилизаторов (биополимеры). Но это не снимает вопросов о токсичности самих наночастиц металлов на стадии использования и утилизации. Нанотехнологии и наночастицы металлов требуют особого отношения к оценке их токсичности, безопасности, возникающих рисков. Это связано с тем, что при переходе от веществ микроразмерных к наноразмерным происходит возрастание диффузионной проникающей способности (малые размеры D = f(1/R) где D - коэффициент диффузии, R - радиус частицы). Одно и то же вещество повышает свою токсичность со снижением R частицы. И лечебные свойства, биоцидность, цитостатичность, токсичность наночастиц металлов зависит от химической природы, размера частицы, её формы, концентрации, состава и структуры окружающей среды. С уменьшением размера наночастицы металлов биоцидность и лечебные свойства, цитостатичность возрастают, что связано с повышением проникающей способности. Но и токсичность по отношению к здоровым клеткам тоже возрастает по той же причине. То же самое с концентрационной зависимостью – все полезные свойства и токсичность возрастают с повышением концентрации. Из этого следует, что необходимо искать «золотое сечение», при котором эффективные свойства будут существенно превышать токсичность. На рис. 1 показана динамика роста публикаций, касающихся использования нанотехнологий в медицине и посвящённых проблемам токсичности.
Рисунок 1.
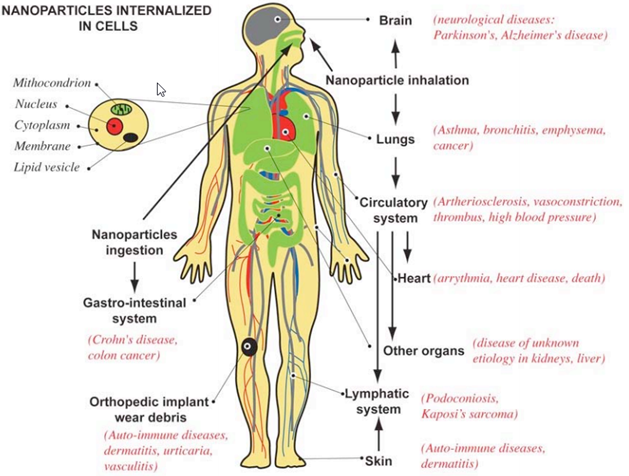
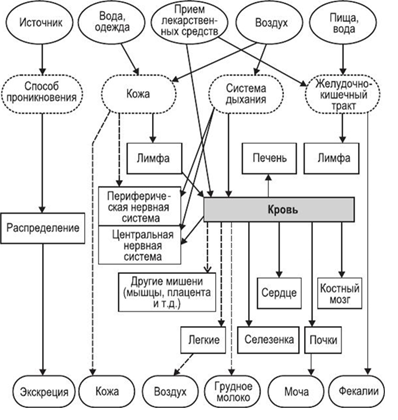
Как можно видеть, исследования токсичности существенно отстают от разработки самих нанотехнологий. Это понятно, поскольку разработкой нанотехнологий занимаются частные, коммерческие структуры, а проблемами токсикологии и безопасности человека и природы при использовании нанотехнологий занимаются правительственные или международные организации. Это серьезная проблема дисбаланса в исследованиях может быть решена только законодательно, предписаниями о необходимости затрачивать определенную долю ассигнований с каждого проекта по нанотехнологиям на доказательства её безопасности. Вопрос очень непростой и требует детального обсуждения с юристами и исследователями. Рассматривая проблему безопасности при использовании нанотехнологий и наночастиц металлов, необходимо разделить её на две отдельные проблемы: – действия наноматериалов и наночастиц металлов на человека; – действие наноматериалов и наночастиц металлов на окружающую среду. Обе эти проблемы тесно связаны. Действие наноматериалов и наночастиц металлов на человека может происходить, когда человек производит, хранит, перевозит, использует наноматериалы и наночастиц металлов или является объектом лечения с помощью наноматериалов и наночастиц металлов. Во всех случаях, попадая в организм человека наночастицы металлов способны накапливаться в определенных органах и тканях человека, и при определенных концентрациях вызывать вредные необратимые изменения в организме. На рис. 2 показано токсичное действие наночастиц на различные органы и ткани человека. На рис. 3 показаны пути проникновения наночастиц в организм.
Рисунок 2.
Во всех органах и тканях наночастицы металлов в зависимости от их концентрации будут проявлять токсичность, как и в случае с клетками микроорганизмов (бактерии, вирусы). Механизм аналогичный и зависимый от концентрации: взаимодействие с мембраной клетки, нарушение структуры мембраны, проникновение в цитоплазму и деструктивное воздействие на все составляющие цитоплазмы (ДНК, РНК, ферменты, рибосома), приводящие к гибели здоровых клеток.
Рисунок 3.
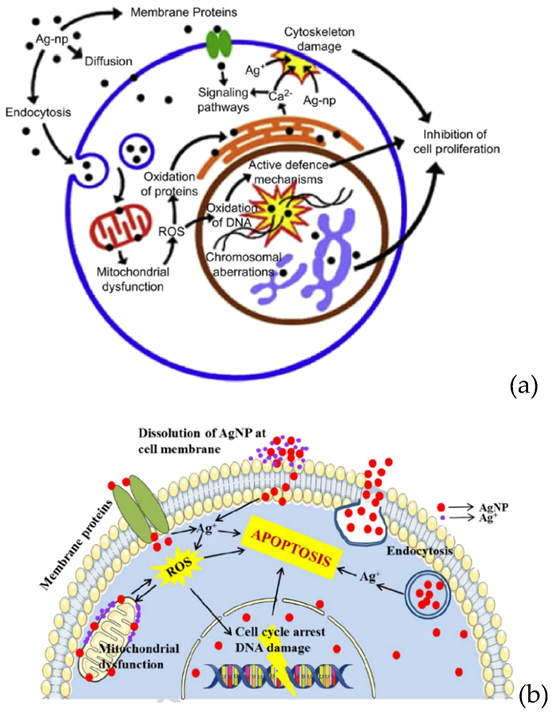
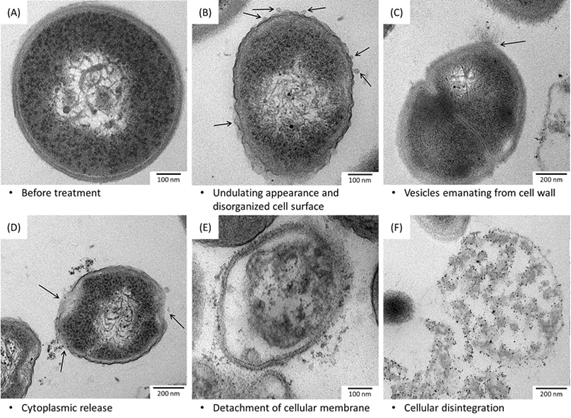
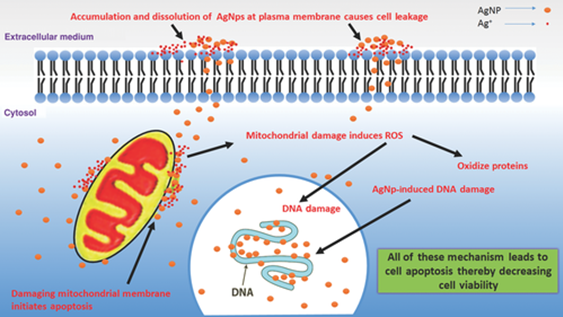
На рис. 4 показаны два из возможных механизмов разрушающего действия наночастиц серебра на здоровую клетку.
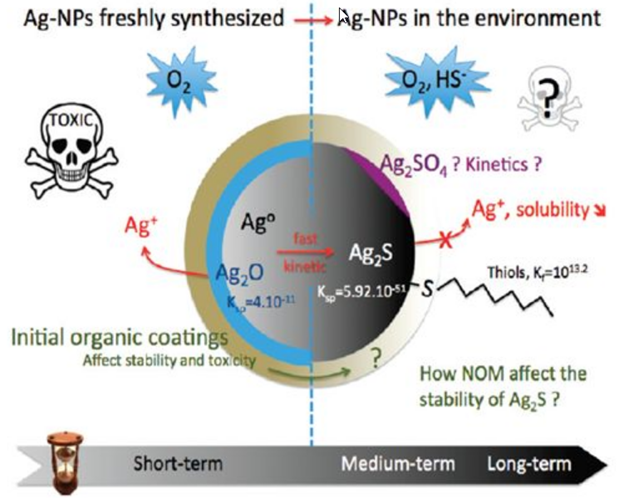
Рисунок 4.
На рис. 5 и 6 показано разрушающее действие наночастиц серебра на клетки бактерий.
Рисунок 5.
Рисунок 6.
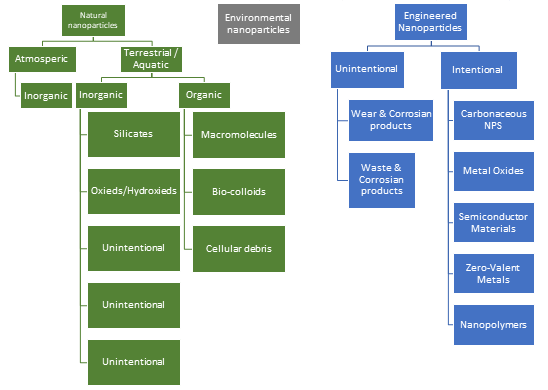
Все эти нежелательные эффекты возникают при определённых критических концентрациях наночастиц металлов, поэтому при использовании их в нанотерапии следует работать при низких концентрациях, при которых лечебный эффект существенно превышает токсичность. В каждом конкретном случае (вид заболевания, особенность пациента и др.) необходимо подбирать необходимую допустимую концентрацию наночастиц металлов. Негативным свойством наночастиц металлов при использовании их в качестве биоцидов является то, что они имеют широкий спектр действия и убивают как патогенные, так и полезные микроорганизмы. Систематические исследования токсичности наночастиц металлов на примере наночастиц серебра разного размера (20-100 нм) invivo на крысах показали резкое увеличение объема селезенки. Наблюдалось накопление наночастиц металлов в селезенке, лимфатических узлах и других органах. Близкая картина накопление наночастиц металлов наблюдается в почках. Из этих органов, где нарушен метаболизм, его продукты могут попадать и в другие органы. Дело в том, что Ag+ является прекурсором в биосинтезе наночастиц серебра и в определенном количестве присутствует в системе. Более того Ag+ может в определенных условиях высвобождаться, выделяться из наночастиц металлов. Многочисленными исследованиями показано, что серебро в форме катиона Ag+ существенно активнее и токсичнее, чем наночастицы серебра. Проникая в здоровую клетку, как и в онкоклетку, клетку бактерии и вируса Ag+ и наночастицы серебра начинают разрушать все составляющие цитоплазмы, что приводит к гибели клетки. Для установления уровня токсичности и механизма токсичности invivo используют модели специально выбранных животных, выступающих в роли стандартных объектов устойчивости к токсичности вещества. точка Таким образцовым животным является рыба зебра (лат. Pterois volitans). На этих объектах было показано, что наночастицы серебра при определенных концентрациях и размерах частиц вызывают смертность этих рыб. Наночастицы металлов и вопросы безопасности окружающей среды Наночастицы могут быть природного и рукотворного происхождения, и в том, и в другом случае могут вызывать нежелательные изменения в атмосфере, в водоемах и почве, куда они могут попадать различными путями. Наночастицы металлов токсичны при определенных концентрациях по отношению ко всем микроорганизмам и патогенным и полезным. Наночастицы металлов вступают с микроорганизмами во взаимодействие с остановкой роста микроорганизмов. В воздухе, водоемах и почве содержится огромное количество соединений органического и минерального характера, с которыми могут реагировать наночастицы металлов. На сегодня исследования о превращениях наночастиц металлов в окружающей среде носят только фрагментарный характер. Трудности этих исследований заключаются: – в широчайшем разнообразии веществ в окружающей среде, потенциально реагирующих с наночастицами металлов; – в широком спектре условий и их изменений в окружающей среде (температура, влажность, солнце и др.); – в необходимости очень дорогого оборудования для анализа. На подведение наночастиц металлов и других наноматериалов в окружающей среде влияют их размер, форма, концентрация и заряд поверхности. На рис. 7 показаны виды природных и рукотворных наноматериалов.
Рисунок 7.
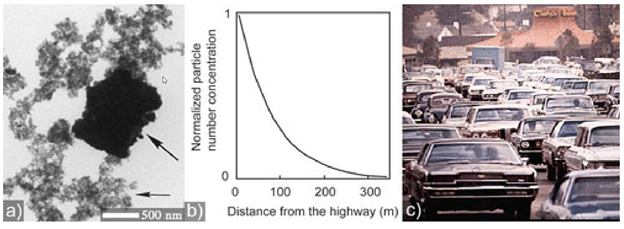
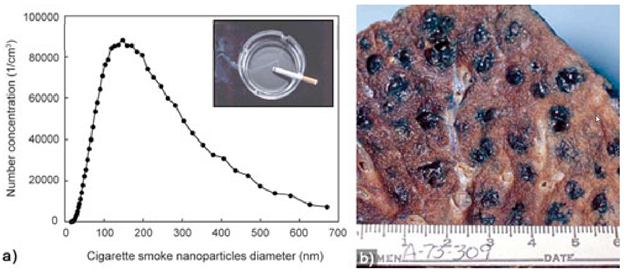
Наночастицы в природе образуются при извержении вулканов (рис.8), содержатся в дыме сигарет и выхлопных газах.
Рисунок 8.
На рис. 9 и 10 показаны источники образования наночастиц и их попадания в окружающую среду.
Рисунок 9.
Рисунок 10. Наночастицы, образующиеся в сигаретном дыму и при сжигании.
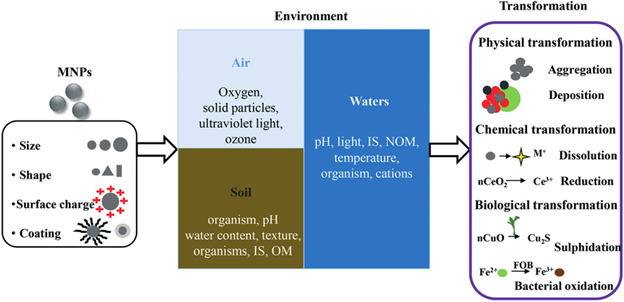
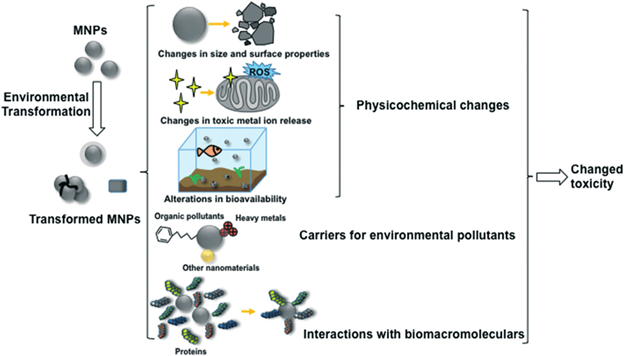
Источниками наночастиц являются выхлопы автомобильных газов, выбросы дыма заводов и фабрик и др. К наночастицам природного происхождения окружающая среда и человек в значительной мере адаптировались, что нельзя сказать о рукотворных наночастицах. При оценке токсичности наночастиц металлов, проявляемой в окружающей среде, надо учитывать то, что в весьма разнообразной внешней среде наночастиц металлов ведут себя иначе, чем они себя вели бы в чистом виде. В окружающей среде, куда наночастиц металлов попадают разными путями (атмосфера, водоёмы, почва), содержатся сотни разнообразных веществ неорганического, органического характера. К тому же во всех этих сферах содержатся несметное количество полезных и патогенных микроорганизмов. Со всеми этими составляющими среды наночастицы металлов могут потенциально реагировать по очень сложным химическим реакциям. С микроорганизмами и биологическими молекулами наночастиц металлов бесспорно могут окисляться с выделением катионов металлов. Очень легко наночастиц металлов реагируют с серой и её соединениями с образованием продуктов взаимодействия. В окружающей среде может происходить агрегация и диспергация наночастиц металлов с изменением их размера и формы. От этих всех изменений будет зависеть токсичность наночастиц металлов во всех сферах окружающей среды по отношению ко всем обитателям окружающей среды и человека. Безусловно химический состав водных бассейнов и почвы намного богаче, чем состав атмосферы, тем более по содержанию микроорганизмов и других живых существ. На рис. 11 показана общая схема трансформации наночастиц металлов во всех трех сферах окружающей среды. Эти превращения зависят от исходных параметров (размер, форма, заряд, окружения). В первую очередь может происходить окисление и фотоокисление наночастиц металлов кислородом, эти реакции зависит от pH среды, температуры, наличия света. Более специфические превращения, связаны с агрегацией, химическими превращениями, растворением, биологической трансформацией, биологическими превращениями.
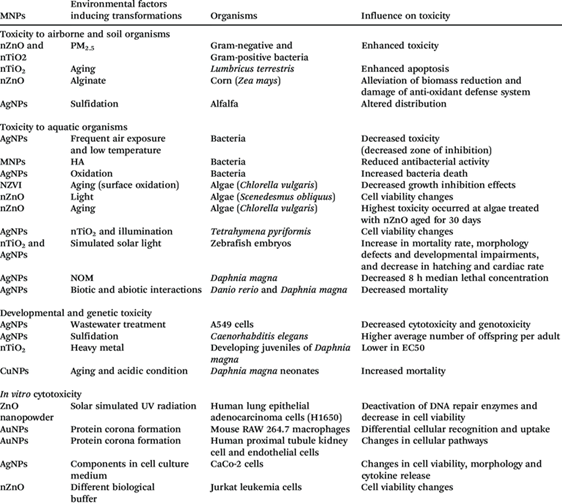
Рисунок 11. Все свойства наночастиц металлов являются зависимыми от концентрации. Это относится и к токсичности. При определённых, высоких концентрациях наночастиц металлов могут подавлять рост растений. При содержании в почве водорастворимых солей металлов растения поглощают катионы металлов и трансформирует их в наночастицы металлов. При низких концентрациях солей металлов в почве все ограничивается этой трансформацией. При более высоких концентрациях, характерных для конкретных растений и для определенных катионов, происходит разрушение клеток растений. В табл. 1 показана токсичность разных наночастиц металлов в окружающей среде. Токсичность оценена по остановке роста микроорганизмов.
Таблица 1.
В водной среде при определённой концентрации наночастицы металлов подавляют рост водорослей различного вида. На рис. 12 показано влияние трансформации наночастиц металлов в окружающей среде на токсичность по отношению к микроорганизмам.
Рисунок 12.
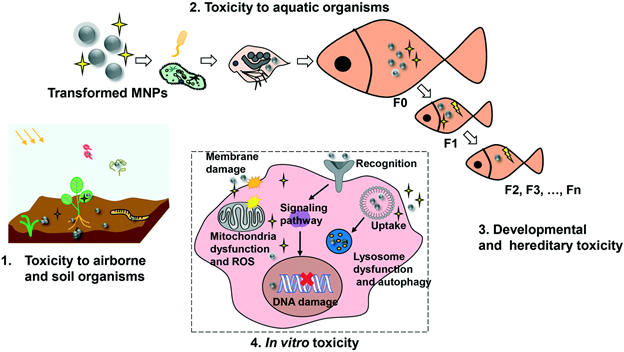
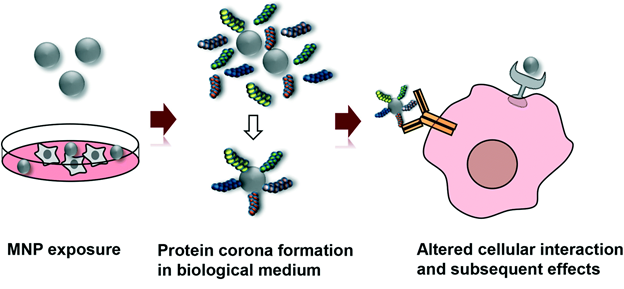
Нахождение наночастиц металлов в окружающей среде обязательно приводит к их разнообразным превращениям, что скажется на механизме их токсичности. Это схематично показано на рис.13. Поскольку во всех сферах окружающей среды присутствуют в большом количестве в разнообразной форме белки, то большая вероятность образования вокруг наночастиц металлов белковой короны, что изменит их взаимодействие с клетками (рис.14). Все трансформации наночастиц металлов в окружающей среде необходимо учитывать при исследование токсичности наночастиц металлов и при выработке стратегии обеспечения безопасности попадания наночастиц металлов в атмосферу, почву, водоемы и, конечно, разными путями в организм человека.
Рисунок 13.
Рисунок 14.
Выводы: – при оценке токсичности наночастиц металлов следует учитывать, что она зависит от размера, формы, их концентрации и поверхностного заряда; – реальная токсичность наночастиц металлов в окружающей среде и в организме человека зависит от состава окружения наночастиц металлов и их взаимодействия с составляющими среды. Использованная литература: 1. Duan H, Wang D, Li Y. Green chemistry for nanoparticle synthesis. Chem Soc Rev. 2015; 44(16):5778-5792. 2. Oves M, Khan MS, Zaidi A, et at. Antibacterial and cytotoxic efficacy of extracellular silver nanoparticles biofabricated from chromium reducing novel OS4 strain of Stenotrophomonas maltophilia. PLoS One. 2013; 8(3):e59140. 3. Qayyum S, Oves M, Khan AU. Obliteration of bacterial growth and biofilm through ROS generation by facilely synthesized green silver nanoparticles. PLoS One. 2017;12(8):e01813638. 4. Berti L, Burley GA. Nucleic acid and nucleotide-mediated synthesis of inorganic nanoparticles. Nat Nanotech- nol. 2008;3(2):81-87. 5. Slade D, Radman M. Oxidative stress resistance in Deinococcus radiodurans. Microbiol Mol Biol Rev. 2011 ;75(1):133-191. 6. Li J, Li Q, Ma X, et al. Biosynthesis of gold nanoparticles by the extreme bacterium Deinococcus radiodurans and an evaluation of their antibacterial properties. Int J Nanomedicine. 2016; 11:5931-5944. 7. Albanese A, Chan WC. Effect of gold nanoparticle aggre¬gation on cell uptake and toxicity. ACS Nano. 2011 ;5(7):5478-5489. 8. Ge L, Li Q, Wang M, Ouyang J, Li X, Xing MM. Nanosilver particles in medical applications: synthesis, performance, 2014;9:2399-407. 9. Tran QH, Nguyen, Van Quy, Le, Anh-Tuan. Silver nanoparticles: synthesis, properties, toxicology, applications and perspectives. Advances in Natural Sciences: Nanoscience and Nanotechnology. 2013;4(3):033001. 10. Prabhu S, Poulose EK. Silver nanoparticles: mechanism of antimicrobial action, synthesis, medical applications, toxicity effects. International Nano Letters. 2012; 2(1):32. 11. Chen X, Schluesener HJ. Nanosilver: A nanoproduct in medical application. Toxicology Letters. 2008;176(1):1-12. 12. Ge L, Li Q, Wang M, Ouyang J, Li X, Xing MM. Nanosilver particles in medical applications: synthesis, performance, 2014;9:2399. 13. Rai MY, Alka Gade Aniket. Silver nanoparticles as a new generation of antimicrobials. Biotechnology advances. 2009;27(1):76-83. 14. Samberg ME, Nancy A. 22 Silver Nanoparticles in Bio-medical Applications. Nanotoxicology: Progress toward Nanomedicine. 2014:405. 15. dos Santos CA, Seckler MM, Ingle AP, Gupta I, Galdiero S, Galdiero M, et al. Silver nanoparticles: therapeutical uses, toxicity, and safety issues. J Pharm Sci. 2014;103(7):1931-44. 16. Poirier M, Simard JC, Antoine F, Girard D. Interaction between silver nanoparticles of 20 nm (AgNP20) and human neutrophils: induction of apoptosis and inhibition of de novo protein synthesis by AgNP20 aggregates. Journal of Applied Toxicology. 2014;34(4):404-12. 17. Pratsinis A, Hervella P, Leroux JC, Pratsinis SE, Sotiriou GA. Toxicity of silver nanoparticles in macrophages. Small. 2013;9(15) :2576-84. 18. Wang Z, Liu S, Ma J, Qu G, Wang X, Yu S, et al. Silver RNA transcription inhibition in erythroid progenitor cells. ACS nano. 2013;7(5):4171-86. 19. Kondoh M, Ohga N, Akiyama K, et al. Hypoxia-induced reactive oxygen species cause chromosomal abnormalities in One. 2013; 8(11 ):e0080349. 20. Majmundar AJ, Wong WJ, Simon MS. Hypoxia-inducible Cell. 2010;40(2):294~309. 21. Lee JS, Kim Y, Bhin J, et al. Hypoxia-induced methylation of a pontin chromatin remodeling factor. Proc Natl Acad Sci USA. 2011;108(33):13510-13515. 22. AshaRani PV, Low Kah Mu Hande MP, Valiyaveettil S. Cytotoxicity and genotoxicity of silver nanoparticles in human cells. ACS Nano. 2009;3(2):279-290. 23. van der Zande M, Vandebriel RJ, Van Doren et al. Distribution, elimination, and toxicity of silver nanoparticles and silver ions in rats after 28-day oral exposure. ACS Nano. 2012;6(8):7427-7442. 24. Mohanty S, Mishra S, Jena P, Jacob B, Sarkar B, Sonawane A. An investigation on the antibacterial, cytotoxic, and antibiofilm efficacy of starch-stabilized silver nanoparticles. Nanomedicine. 2012;8(6):916-924. 25. Pratsinis A, Hervella P, Leroux J, SE, Sotiriou GA. Toxicity of silver nanoparticles in macrophages. Small. 2013;9(15):2576-2584. 26. Jeong JK, Gurunathan S, Kang MH, et al. Hypoxiamediated autophagic flux inhibits silver nanoparticle triggered apoptosis in human lung cancer cells. Sci Rep/ 2016; 6:21668. 27. de Lima R, Seabra AB, Duran N. Silver nanoparticles: a brief review of cytotoxicity and genotoxicity of chemically and biogenically synthesized nanoparticles. J Appl Toxicol. 2012,32(11):867-879. 28. Sambale F, Wagner S, Stah Khaydarov RR, T, Bahnemann D. Investigations of the toxic effect of silver nanoparticles on mammalian cell lines. J Nanomater. 2015; 2015:136765. 29. Lim D, Roh JY, Eom HJ, Choi JY, Hyun J, Choi J, Oxidative stress-related PMK-1 P38 МАРК activation as a mechanism for toxicity of silver nanoparticles to reproduction in the nematode Caenorhabditis elegans. Environ Toxicol Chem. 2012;31(3) .585-592. 30. Г.Е. Кричевский. 3-х томник «Зеленые и Природоподобные технологии – основа устойчивого развития для будущих поколений. Т.3, глава «Токсичность наночастиц металлов», М.2020, «ГринПринт», с.343-394. Комментарии:Пока комментариев нет. Станьте первым! |